Aktuality
Bezpečnost a snášenlivost anti-CGRP monoklonálních protilátek a gepantů v prevenci migrény: Systematický přehled a síťová metaanalýza

Záchvaty migrény mohou být vysoce invalidizující, mohou významně zhoršit kvalitu života a vést ke ztrátě produktivity. Migréna je navíc první příčinou invalidity u lidí mladších 50 let. Preventivní léčba migrény je primárně zaměřena na snížení frekvence bolesti hlavy, závažnosti ataky, invalidity pacienta a rizika nadměrného užívání léků. Účinná prevence může také zlepšit kvalitu života pacientů a odpověď na akutní léčbu. Při rozhodování o preventivní léčbě je důležité vzít v úvahu závažnost a frekvenci záchvatů migrény, předchozí léčebnou anamnézu, přítomnost komorbidit, použití souběžných léků, stejně jako účinnost léčby, bezpečnost a vedlejší účinky. Přiměřená snášenlivost je nezbytná pro zajištění compliance pacientů, a tím i účinnosti léčby. Nejčastějšími důvody špatné compliance a adherence k perorální léčbě běžně používané k prevenci migrény jsou špatná snášenlivost a vysoký počet nežádoucích účinků. Doposud užívaná preventivní terapie má svá úskalí a často není úspěšná. Počet pacientů odpovídajících na léčbu je pouze 45 %, po šesti měsících užívá profylaktickou léčbu pouze čtvrtina nemocných, po 12 měsících 86 % pacientů léčbu ukončí.
Specifickou profylaxi migrény představují anti-CGRP monoklonální protilátky, léky zasahující cíleně do patogeneze migrény. V parenterální formě se v klinické praxi používají protilátky, které cílí buď na receptor pro CGRP (erenumab), nebo na ligand CGRP (galkanezumab, fremanezumab, eptinezumab). Novinkou jsou také gepanty, malé molekuly, cílící na receptor CGRP, které se podávají ve formě tablet.
Cílem tohoto systematického přehledu se síťovou analýzou bylo porovnání bezpečnosti a snášenlivosti monoklonálních protilátek a gepantů v prevenci migrény. Podklady byla data z celkem 19 studií (publikace z období od listopadu 2017 do listopadu 2021), kterých se zúčastnilo 14 584 pacientů, u nichž byla použita tato terapeutická intervence: atogepant, eptinezumab, erenumab, galkanezumab, rimegepant, fremanezumab. Sledovanými primárními výsledky byl výskyt nežádoucích účinků související s léčbou (TEAE) a závažné nežádoucí účinky (SAE). Sekundárními výstupy byly jakékoli nežádoucí účinky (NÚ) a NÚ vedoucí k přerušení léčby.
Výsledky
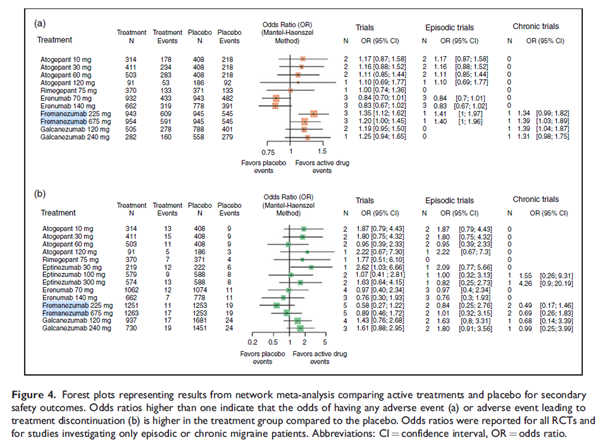
K přerušení léčby z důvodů nežádoucích účinků docházelo nejméně často při léčbě fremanezumabem podáváném jednou za tři měsíce. U eptinezumabu 300 mg byl výskyt NÚ vedoucích k přerušení léčby nejvyšší.
Atogepant 120 mg a galkanezumab 240 mg vykazovaly ve srovnání s placebem, eptinezumabem a fremanezumabem největší výskyt NÚ vyvolaných léčbou. Nejnižší výskyt nežádoucích účinků a závažných nežádoucích účinků vykazoval eptinezumab a nejnižší výskyt jakýchkoli nežádoucích účinků vykazoval erenumab. Mezi aktivní léčbou a placebem nebyly zjištěny žádné významné rozdíly v závažných nežádoucích účincích.
Jak síťová metaanalýza, tak přímá srovnání mezi aktivními léky a placebem ukázaly vyšší výskyt TEAE během léčby galkanezumabem (120 mg a 240 mg) a fremanezumabem (225 mg a 675 mg) ve srovnání s placebem. Významný efekt spojený s fremanezumabem lze pravděpodobně vysvětlit velkým počtem studií a pacientů s touto léčbou. Při párovém srovnání byla pozorována určitá heterogenita mezi randomizovanými klinickými studiemi (RCT), a to zejména u galkanezumabu a fremanezumabu. Studie zkoumající galkanezumab pouze u pacientů s chronickou migrénou prokázala mnohem větší efekt ve srovnání s jinými studiemi, které zahrnovaly pacienty s epizodickou i chronickou migrénou léčené galkanezumabem. Pokud jde o fremanezumab, dvě studie ukázaly vyšší výskyt TEAE ve srovnání s placebem, zatímco v jiné studii byl pozorován vyšší výskyt TEAE u placeba než u fremanezumabu a ve dvou dalších RCT byl téměř stejný výskyt TEAE u fremanezumabu a placeba.
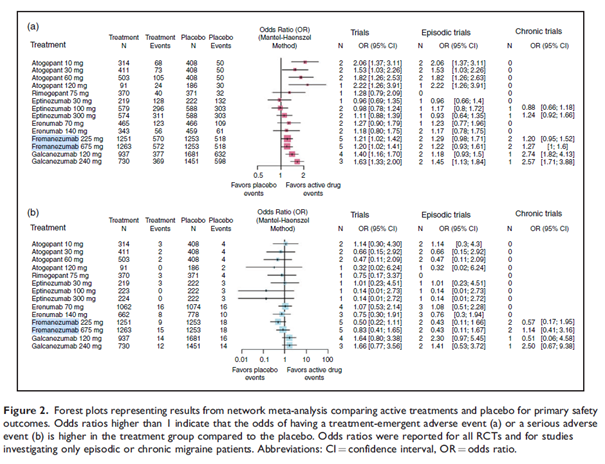
Síťová metaanalýza porovnávající aktivní léčby proti sobě prokázala, že pacienti léčení atogepantem (všechny dávky) měli vyšší výskyt TEAE ve srovnání s pacienty, kteří dostávali jakýkoli jiný aktivní lék (s výjimkou jediného srovnání, z něhož bylo téměř 40 % srovnání signifikantních). Léčba galkanezumabem (120 mg a 240 mg) vykazovala vyšší pravděpodobnost výskytu TEAE ve srovnání se všemi aktivními látkami s výjimkou atogepantu, přičemž téměř 40 % srovnání bylo signifikantních. Léčba galkanezumabem (120 mg a 240 mg) byla také spojena s významně vyšší pravděpodobností výskytu SAE ve srovnání s léčbou fremanezumabem 225 mg.
Ačkoli téměř 40 % pacientů s epizodickou migrénou a téměř všichni pacienti s chronickou migrénou by měli z prevence prospěch, pouze 2–13 % pacientů s migrénou dostává preventivní léčbu. To je z velké části způsobeno špatnou snášenlivostí klasické perorální léčby migrény. Existují důkazy, že perzistence k takovým terapiím se pohybuje od 7 do 55 % po 12 měsících. Udává se také, že nízká perzistence k orální léčbě je spojena s větším využíváním zdrojů a nákladů na zdravotní péči. Špatná snášenlivost a vysoký stupeň nežádoucích účinků jsou nejčastějšími důvody špatné compliance a dodržování léčby klasickými perorálními preventivními přípravky proti migréně. Jednou z hlavních předností nových profylaktických terapií migrény zaměřených na dráhu CGRP je jejich bezkonkurenčně příznivý profil bezpečnosti a snášenlivosti ve srovnání s klasickými perorálními preventivními přípravky proti migréně. Navíc při parenterálním podávání anti-CGRP monoklonálních protilátek odpadá problém s dodržováním dávkovacích schémat.
Závěr
Výsledky síťové metaanalýzy potvrdily, že anti-CGRP protilátky a gepanty jsou v prevenci migrény bezpečnou a dobře snášenou možností, která zřídka vede k přerušení léčby.
Reference
Messina R, et al. Safety and tolerability of monoclonal antibodies targeting the CGRP pathway and gepants in migraine prevention: A systematic review and network meta-analysis. Cephalalgia 2023;43:3331024231152169. doi: 10.1177/03331024231152169. PMID: 36786548.


